Dizolvarea ca proces fizico-chimic. Fenomene termice care însoțesc dizolvarea substanțelor
Dizolvarea ca proces fizico-chimic
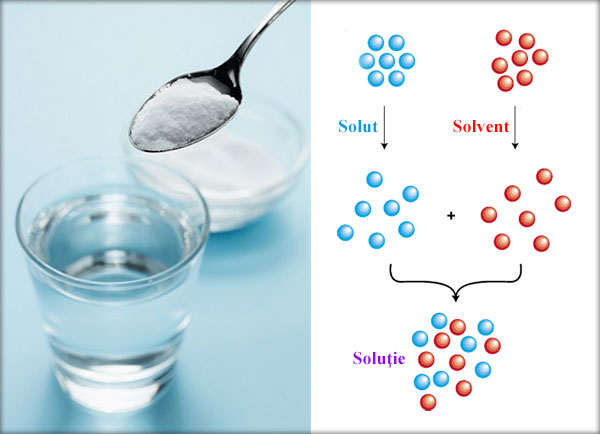
Dizolvarea este un proces fizico-chimic în care moleculele sau ionii unei substanțe (solutul) sunt dispersați uniform într-o altă substanță (solventul), formând o soluție. În timpul dizolvării, interacțiunile dintre moleculele solutului și moleculele solventului joacă un rol crucial. Aceste interacțiuni includ forțe de atracție și repulsie care determină cât de bine se amestecă cele două substanțe. În general, dizolvarea implică trei etape principale: disocierea moleculelor solutului, separarea moleculelor solventului pentru a face loc solutului și interacțiunea solut-solvent.
Interacțiunile solut-solvent
Procesul de dizolvare depinde în mare măsură de natura chimică a solutului și a solventului. Soluțiile se formează mai ușor atunci când solutul și solventul au proprietăți similare, adesea enunțat prin principiul „asemănător dizolvă asemănător”. De exemplu, substanțele polare, cum ar fi sărurile și zahărul, se dizolvă bine în solvenți polari precum apa, deoarece interacțiunile dipol-dipol și legăturile de hidrogen facilitează dizolvarea. Pe de altă parte, substanțele nepolare, cum ar fi uleiurile, se dizolvă mai bine în solvenți nepolari, cum ar fi benzina, datorită interacțiunilor de tip forțe van der Waals.
Fenomene termice asociate dizolvării
Dizolvarea substanțelor poate fi însoțită de fenomene termice, rezultând în procese endoterme sau exoterme. Într-un proces endoterm, energia necesară pentru a rupe legăturile în solut și în solvent este mai mare decât energia eliberată în timpul formării noilor interacțiuni solut-solvent. Acest tip de dizolvare absoarbe căldură din mediul înconjurător, ceea ce duce la o scădere a temperaturii soluției. Un exemplu comun este dizolvarea nitratului de amoniu în apă, care este folosit în pachetele de gheață instantanee.
Dizolvarea exoterma
Într-un proces exoterme, energia eliberată în timpul formării interacțiunilor solut-solvent este mai mare decât energia necesară pentru a rupe legăturile inițiale în solut și solvent. Aceasta rezultă în eliberarea de căldură, ducând la o creștere a temperaturii soluției. Un exemplu clasic este dizolvarea hidroxidului de sodiu în apă, care generează o cantitate semnificativă de căldură, fiind utilizat deseori în aplicații industriale care necesită soluții alcaline fierbinți.
Aplicabilitatea fenomenelor termice în practică
Înțelegerea fenomenelor termice care însoțesc dizolvarea este crucială în diverse domenii, de la chimia industrială la procesele biologice. De exemplu, în industria alimentară, fenomenele endoterme și exoterme sunt exploatate pentru controlul temperaturii în procesele de producție și conservare. În medicină, soluțiile perfuzabile trebuie adesea preparate la temperaturi specifice pentru a menține stabilitatea compușilor activi. Astfel, cunoașterea comportamentului termic al soluțiilor nu doar explică fenomenele observate, dar și optimizează procesele tehnologice și aplicative.
 07.05.2024
07.05.2024