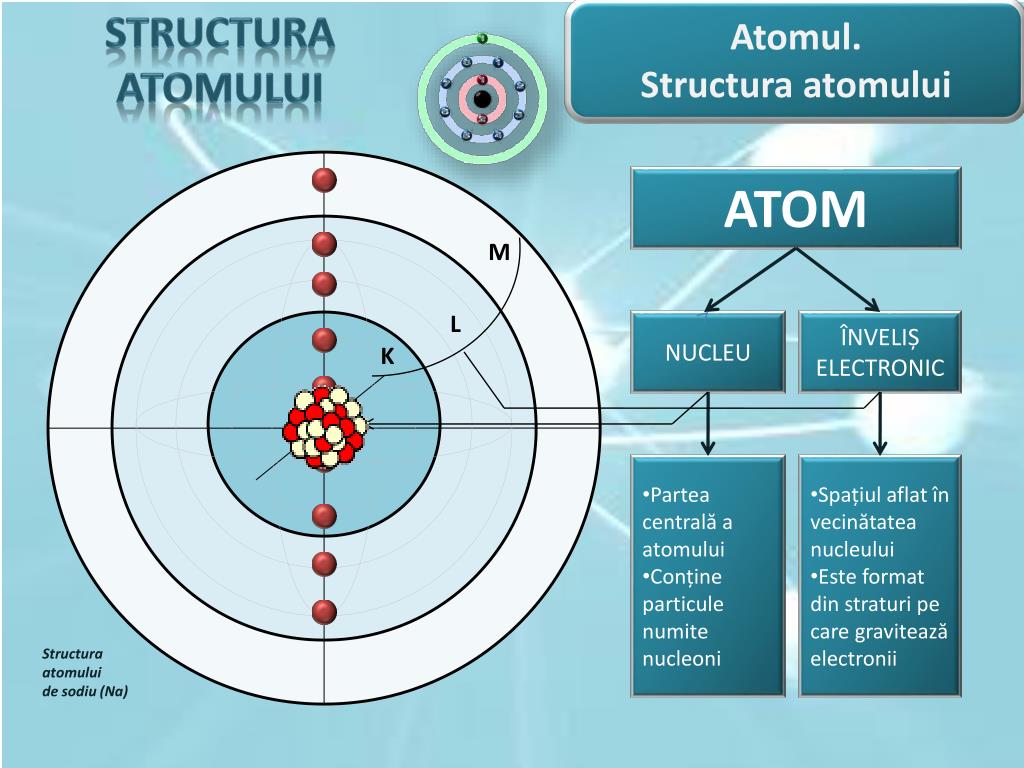
Experimentele lui Rutherford și modelul modern al atomului

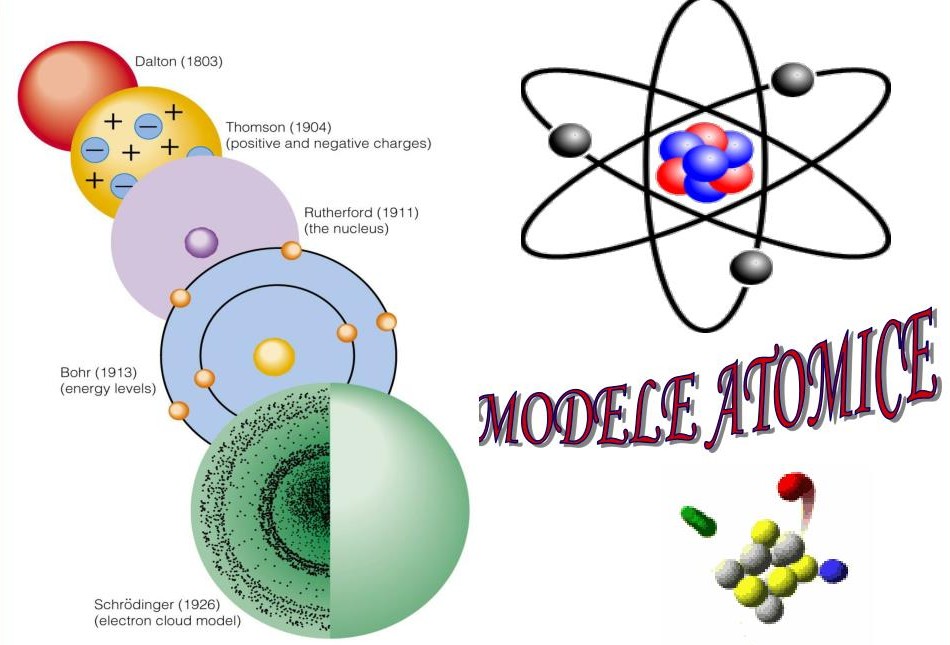
La începutul secolului XX, oamenii de știință încercau să înțeleagă structura materiei și modul în care sunt aranjate particulele elementare în interiorul atomului. Până atunci, cel mai cunoscut model era modelul atomic al lui Thomson (numit și „modelul plum-pudding”), conform căruia atomul era o sferă încărcată pozitiv, în interiorul căreia electronii, particule cu sarcină negativă, erau distribuiți ca niște „stafide într-un cozonac”.
Experimentul lui Rutherford (1909–1911)
Pentru a verifica aceste ipoteze, fizicianul britanic Ernest Rutherford împreună cu colaboratorii săi Hans Geiger și Ernest Marsden au realizat un experiment celebru, cunoscut sub numele de experimentul cu folia de aur.
Descrierea experimentului:
- S-a utilizat o sursă de particule alfa (nuclee de heliu încărcate pozitiv), emise cu viteză mare.
- Particulele alfa au fost îndreptate către o foiță subțire de aur, având doar câțiva atomi în grosime.
- În jurul foiței s-a plasat un ecran fluorescent, care lumina atunci când era lovit de o particulă alfa.
Rezultatele obținute:
- Majoritatea particulelor alfa au trecut prin foița de aur fără să fie deviate.
- Unele particule au fost deviate la unghiuri mici.
- Spre surprinderea cercetătorilor, un număr foarte mic de particule (aprox. 1 la 8000) s-au întors aproape în direcția din care au venit, adică au fost deviate la unghiuri foarte mari.
Concluziile lui Rutherford
Pe baza acestor observații, Rutherford a tras următoarele concluzii:
- Atomul este format în mare parte din spațiu gol, deoarece cele mai multe particule au trecut fără deviații.
- În centrul atomului există o zonă foarte mică, dar foarte densă și încărcată pozitiv, care respinge particulele alfa – aceasta a fost denumită nucleu atomic.
- Electronii se află în jurul nucleului, menținând echilibrul electric al atomului.
Astfel, Rutherford a propus un nou model atomic (1911), cunoscut ca modelul planetar al atomului, în care electronii orbitează în jurul nucleului, asemănător planetelor care se rotesc în jurul Soarelui.
Limitele modelului lui Rutherford
Deși a fost un pas uriaș înainte, modelul lui Rutherford nu putea explica de ce electronii, fiind particule încărcate electric și aflate în mișcare, nu pierd energie și nu cad în nucleu. Conform legilor electromagnetismului, electronii ar fi trebuit să radieze energie și să colapseze în nucleu, ceea ce nu se întâmpla.
Modelul modern al atomului
Problema a fost rezolvată de Niels Bohr (1913), care a îmbunătățit modelul lui Rutherford prin introducerea unor concepte noi:
- Electronii se află pe orbite cuantificate, adică pe niveluri de energie bine determinate.
- Atât timp cât electronii rămân pe aceste orbite, ei nu pierd energie.
- Electronii pot trece de pe o orbită pe alta doar prin absorbția sau emisia unor pachete discrete de energie numite cuante.
Ulterior, dezvoltarea mecanicii cuantice (în secolul XX) a condus la modelul atomic modern, unde electronii nu mai sunt descriși ca particule care se mișcă pe orbite circulare, ci ca având o distribuție de probabilitate în jurul nucleului – zone numite orbitali.
Importanța experimentului lui Rutherford
- A schimbat radical concepția despre atom.
- A dus la descoperirea nucleului atomic și la dezvoltarea fizicii nucleare.
- A pus bazele înțelegerii reacțiilor nucleare și a mecanicii cuantice.
Exerciții – Experimentele lui Rutherford și modelul modern al atomului
I. Întrebări grilă (alege răspunsul corect)
- În modelul lui Thomson, atomul era:
a) format din nucleu și electroni pe orbite
b) o sferă încărcată pozitiv cu electronii distribuiți în interior
c) alcătuit doar din electroni
d) alcătuit doar din protoni
- În experimentul cu folia de aur, Rutherford a bombardat foița cu:
a) electroni
b) protoni
c) particule alfa
d) neutroni
- Rezultatul neașteptat al experimentului a fost:
a) toate particulele au trecut nestingherite prin foiță
b) nicio particulă nu a trecut prin foiță
c) unele particule au fost deviate puternic, chiar și la unghiuri de 180°
d) particulele au rămas blocate în foița de aur
- Modelul planetar al lui Rutherford:
a) descrie electronii staționari în interiorul atomului
b) arată electronii rotindu-se în jurul nucleului ca planetele în jurul Soarelui
c) arată că electronii se află numai în nucleu
d) explică perfect stabilitatea atomului
- Îmbunătățirea modelului Rutherford prin modelul Bohr constă în:
a) introducerea neutronului în nucleu
b) ipoteza existenței orbitelor cuantificate pentru electroni
c) negarea existenței nucleului
d) demonstrarea faptului că atomul este gol
II. Întrebări deschise
- Explică de ce majoritatea particulelor alfa au trecut prin foița de aur fără deviație.
- De ce au fost câteva particule alfa deviate la unghiuri mari?
- Care este asemănarea dintre modelul planetar al lui Rutherford și sistemul solar?
- Care a fost principala limită a modelului lui Rutherford?
- Cum a explicat Bohr stabilitatea electronilor pe orbite în jurul nucleului?
III. Probleme simple
- Într-un experiment, 20 000 de particule alfa au fost trimise spre o foiță de aur. Dacă 1 din 10 000 de particule este deviată la un unghi mai mare de 90°, câte particule vor fi puternic deviate?
- Două particule alfa se apropie de nucleul unui atom de aur. Una trece nestingherită, iar cealaltă este deviată la 120°. Explică prin ce se deosebește traiectoria lor și ce înseamnă aceasta despre structura atomului.
- Considerând modelul planetar al lui Rutherford: dacă electronul se rotește pe o orbită de rază r=5×10−11 mr = 5 \times 10^{-11} \, \text{m}, calculează ordinea de mărime a suprafeței atomului:
S=πr2S = \pi r^2
 28.05.2025
28.05.2025